- Новини
- Входно ниво
- 4 клас
- 5 клас
- 6 клас
- 7 клас
- 8 клас (9 ЕП клас)
- 9 клас (10 ЕП клас)
- 10 клас (11 ЕП клас)
- 11 клас (12 ЕП клас)
- Изходно ниво
- HBO за 7 клас
- Матура по Физика
- Олимпиада по Физика
- Състезания по физика и астрономия
- Човекът и природата
- Астрономия
- Физика
- Физика с усмивка
- Само факти
- Велики физици
- Нобелова награда по Физика
- За мен
Квантовият атомен модел на Бор на 100 години

Атомният модел на Нилс Бор, публикуван през 1913 г. е оказал огромно влияние върху историята на физиката и може да се определи като една от научните икони на 20 век. Американския институт по физика и Нилс Бор Архив, Дания, отбелязват 100 - годишнината на модела с календар, в който са поместени исторически снимки от кариерата на Бор.

Нилс Бор (1885 - 1962)
Нобелова награда по физика - 1922 г. „За заслуги в изследването на строежа на атомите и тяхното излъчване“.
Да си припомним накратно основните моменти в този модел.
Нилс Бор създава своя квантов модел на водородния атом с цел да обясни особеностите в неговия спектър. Моделът съчетава елементи от класическата физика и новите квантови идеи родени в началото на 20 век. Квантовият модел е изграден върху три основни твърдения, наречени постулати.
1. постулат
Електронът се движи по кръгови орбити около протона (ядрото).
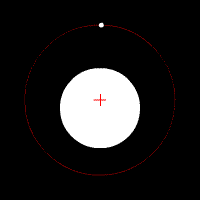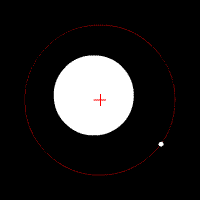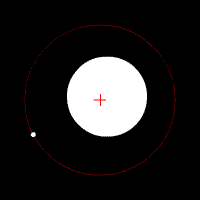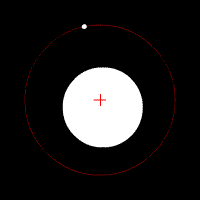
Движението се причинява от електричната сила, с която протонът привлича електрона. В случая електричната сила изпълнява ролята на центростремителна сила. Радиусът на орбитата на електрона е пропорционален на енергията на електрона.
2. постулат
Съществуват стабилни (разрешени, стационарни) орбити на електрона.
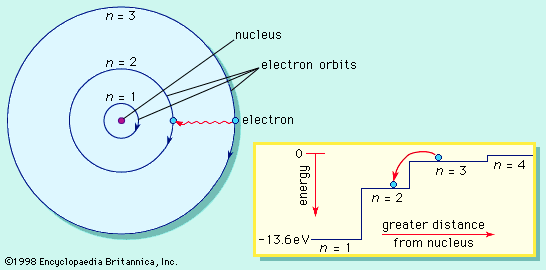
Когато се намира на такава орбита електронът не излъчва енергия. Всяка стационарна орбита се характеризира със строго определен радиус и съответно точно определена енергия на електрона.
Радиусът на най-близката до ядрото орбита, наречен радиус на Бор, има стойност r1 = 5,29.10–11m. Радиусите на следващите разрешени орбити се намират по формулата:
rn = n2 r1, n = 1,2,3…
Върху първата разрешена орбита (n = 1) енергията на електрона е минимална със стойност Е1 = –13,6 еV. Върху следващите стационарни орбити съответно електронът има енергия определена по формулата:
Еn = Е1/ n2 = – 13,6 еV/ n2 ,n = 1,2,3…
Ако електрона получи енергия Е = 13,6 еV, това ще бъде достатъчно той да се откъсне от атома т.е. това е най – голямата необходима енергия за разрушаване на водородния атом.
Формулите за позволените радиуси и енергии показват, че те приемат само дискретни (определени) стойности. Тази същност се нарича квантуване. Квантовото число n определя състоянието на електрона и неговата енергия, наречена енергетично ниво. Състоянието при n = 1 с минимален радиус на орбитата и минимална енергия се нарича основно състояние. Всяко друго разрешено състояние се определя като възбудено състояние с n > 1.
3. постулат
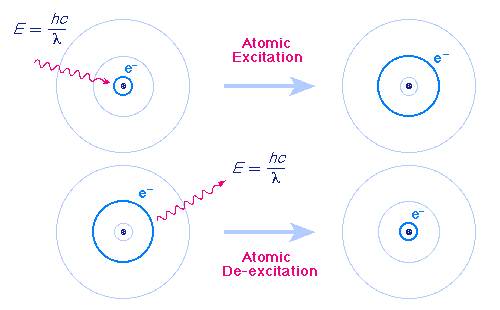
Атомът излъчва фотон, когато електронът «прескача» от орбита с по - голяма енергия на орбита с по - малка енергия. При поглъщане на фотон «прескачането» е в обратна посока – от ниска към по- висока орбита.
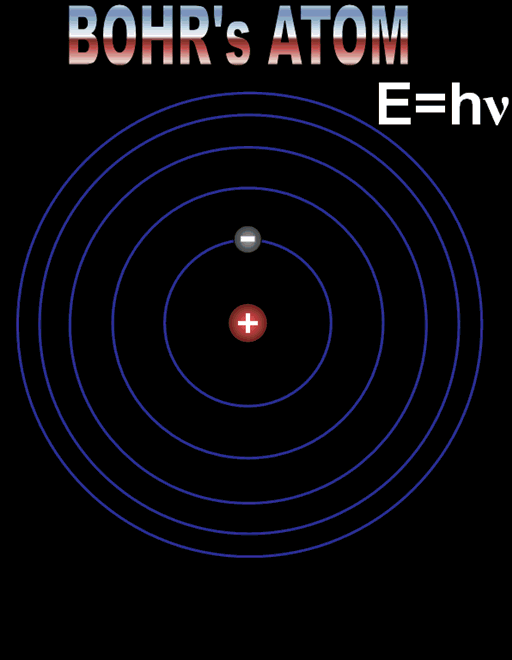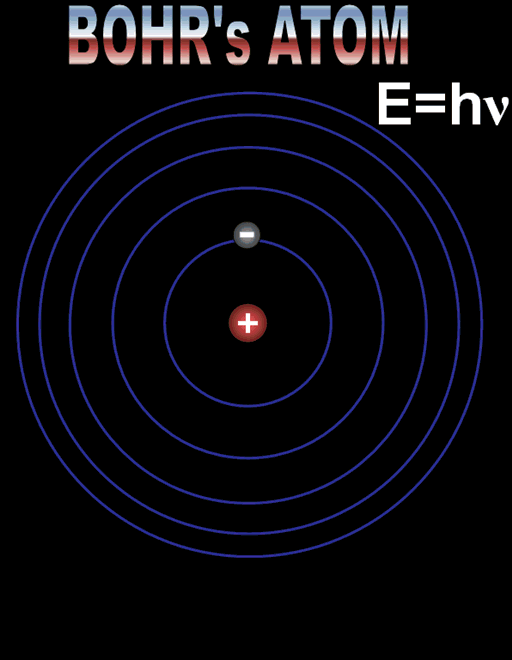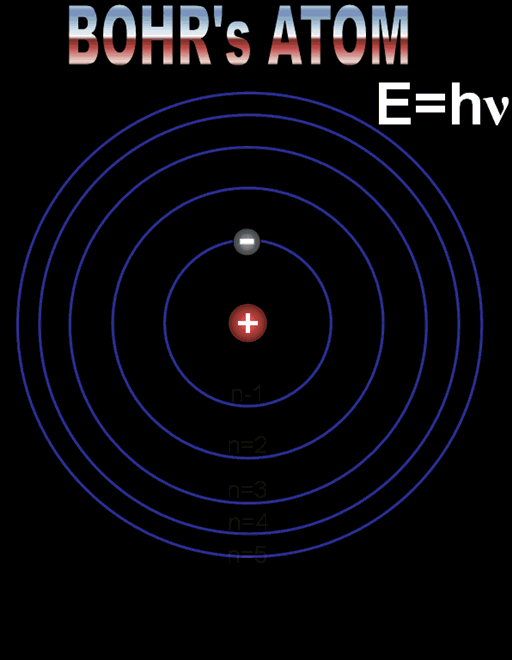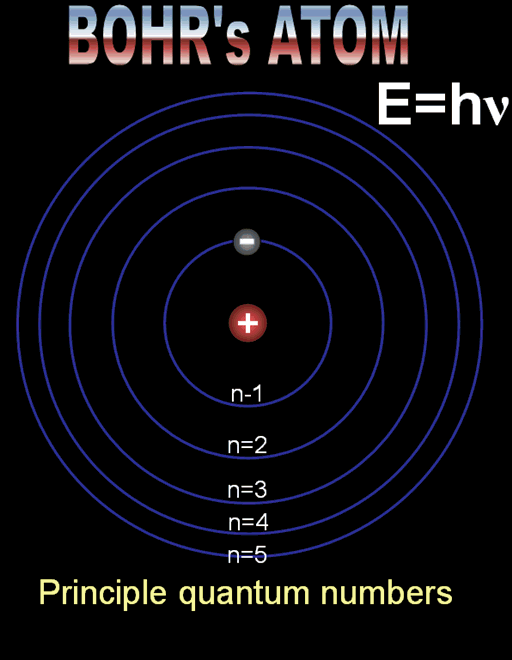

Енергията на излъчения (погълнат) фотон е равна на разликата в енергиите на началното и крайното състояние hν = En – Em. Атомът поглъща само фотони с енергия, която той може да излъчи при възбуждане.
- Log in to post comments
- 11102 reads
