- Новини
- Входно ниво
- 4 клас
- 5 клас
- 6 клас
- 7 клас
- 8 клас (9 ЕП клас)
- 9 клас (10 ЕП клас)
- 10 клас (11 ЕП клас)
- 11 клас (12 ЕП клас)
- Изходно ниво
- HBO за 7 клас
- Матура по Физика
- Олимпиада по Физика
- Състезания по физика и астрономия
- Човекът и природата
- Астрономия
- Физика
- Физика с усмивка
- Само факти
- Велики физици
- Нобелова награда по Физика
- За мен
Изопроцеси при идеален газ

1. Състояние на газ
Състоянието на един газ е напълно определено, ако са известни три негови основни характеристики (величини): обем V (m3), налягане р (Ра) и температура Т (К).
2. Газов процес
Когато едновременно се изменят две или три от посочените величини се осъществява газов процес.
3. Идеален газ
Идеалният газ е физичен модел на газ, в който са направени следните приближения:
а) Молекулите на газа се движат свободно и взамодействат само при удар помежду си.
б) Обемът на всички молекули се приема за пренебрежимо малък спрямо обема на съда, в който е затворен газът.
Реалните газове не се различават по свойства от идеалния газ при стайна температура и нормално атмосферно налягане. Различията са съществени при много ниски температури и налягане стотици пъти по-голямо от атмосферното.
3. Изопроцеси при газовете
Изопроцеси протичат когато една от характеристиките на газовете остава постоянна, а останалите две се променят с течение на времето. При посочените условия е възможно протичане на три изопроцеса – изотермен, изохорен и изобарен. Законите относно изопроцесите са приложими за реални газове, които покриват изискванията на модела идеален газ.
а) Изотермен процес
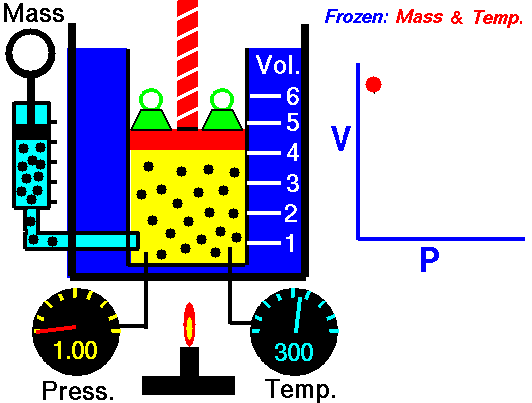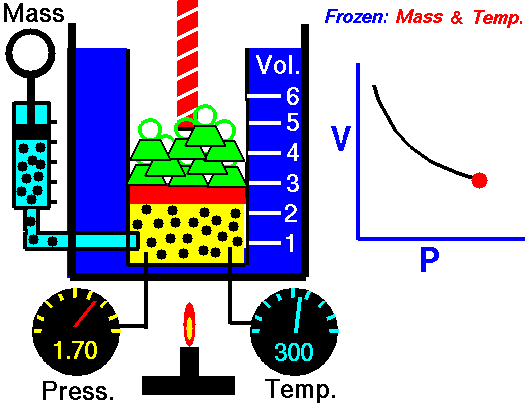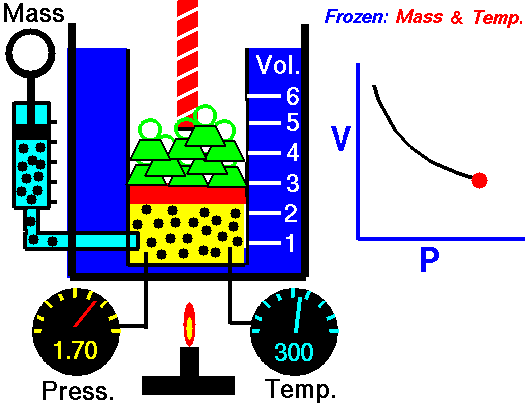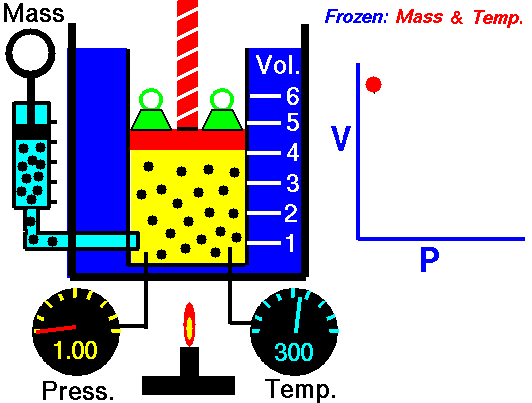
Процес, който протича при постоянна Т = const и се подчинява на закона на Бойл – Мариот: р.V = const или р1 V1 = р2 V2 относно началното и крайно състояние на газа, се нарича изотермен процес.
Законът е изведен за първи път от британеца Робърт Бойл (1662) и французина Едмон Мариот (1676). При изотермен процес произведението от налягането и обемът на определено количество газ е постоянна величина. Графиката на процеса в рV – диаграма е крива, която се нарича изотерма.
б) Изохорен процес
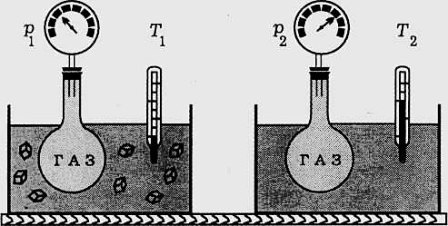
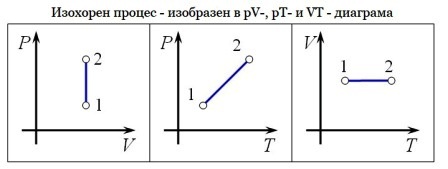
Процес, който протича при постоянен обем V= const и се подчинява на закона на Шарл: р/Т = constили р1/Т2 = р2/Т1 относно началното и крайно състояние на газа, се нарича изохорен процес.
Законът е изведен опитно от французина Жак Шарл (1787). При изохорен процес отношението на налягането към температурата остава постоянно. Графиката на процеса в рV – диаграма е права линия, която се нарича изохора.
Поведението на газовете при изохорен процес лесно обяснява забраната флаконите и бутилките с газ да не се оставят на пряка слънчева светлина.
в) Изобарен процес
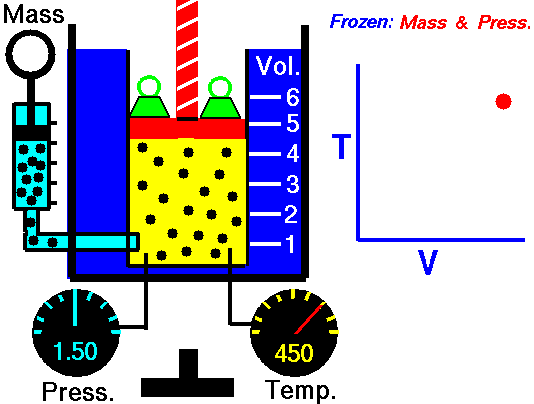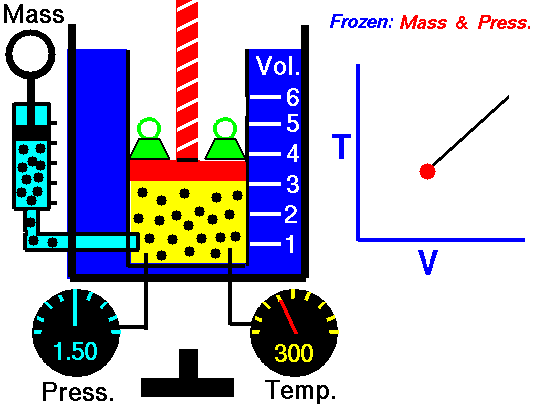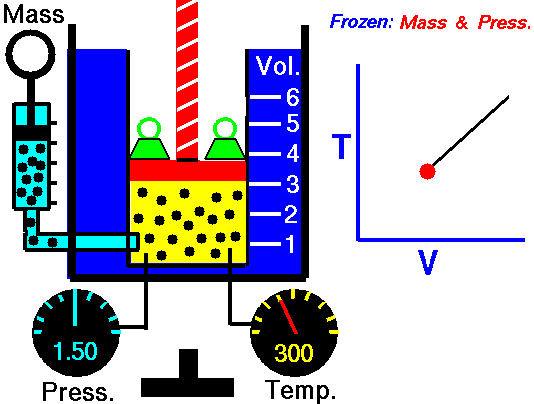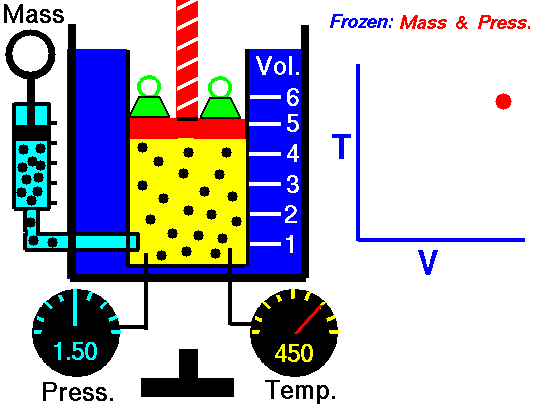
Процес, който протича при постоянно налягане р = const и се подчинява на закона на Гей-Люсак: V/Т = const или V1/Т2 = V2/Т1 относно началното и крайно състояние на газа, се нарича изобарен процес.
Законът е изведен опитно от французина Жозеф Гей-Люсак (1802). При изобарен процес отношението на обема към температурата остава постоянно. Графиката на процеса в рV – диаграма е права линия, която се нарича изобара.
Законите на Бойл-Мариот, Шарл и Гей-Люсак са в сила само идеален газ. При абсолютната нула (Т= 0К = -273,15оС) обемът и налягането на идеален газ са равни на нула (V= 0, р = 0), поради което графиките в рТ – и VТ – диаграми преминават през началото на координатната система. Моделът на идеалния газ не отчита обема и взаимодействието на молекулите. При много ниски температури реалните газове се втечняват и законите за идеалния газ за тях престават да са в сила.
- Log in to post comments
- 65644 reads
